Atualizado 26 de novembro de 2025 por Sergio A. Loiola
A pesquisa pode revolucionar o tratamento do câncer colorretal, o segundo mais comum no Brasil. Matheus Henrique Dias, biomédico e especialista em biologia molecular, descobriu que, em vez de tentar parar as células cancerígenas, é possível estimulá-las até que sobrecarreguem, levando-as à morte.
O Tratamento será testado na Europa.

A ideia pode parecer contraditória, mas foi exatamente analisando como as células reagiam ao serem superestimuladas que o pesquisador descobriu o tratamento, que vai na contramão de tudo que se conhece hoje.
Tratamentos convencionais, como quimio e radioterapia, por exemplo, agem para frear a reprodução das células do tumor cancerígeno, um amontoado de células que se perdem da rota natural por uma mutação no DNA e começam a se multiplicar de forma desordenada.
O estudo, citado em importantes revistas científicas, está sendo conduzido pelo biomédico em um dos mais renomados institutos de pesquisa sobre o câncer na Europa, o Instituto do Câncer da Holanda.
O tratamento vai entrar na primeira fase de testes, já com pacientes, nos próximos meses. Depois disso, serão necessárias novas etapas até que possa ficar disponível.
🔔 Inscreva-se na Nature & Space no YouTube, Explore Nossas Coleções Temáticas!
LEIA MAIS
UFMG DESENVOLVE NANOTECNOLOGIA CONTRA CÂNCER DE INTESTINO
EXAME DE SANGUE PREVÊ ALZHEIMER COM 30 ANOS DE ANTECEDÊNCIA
‘Acidente de laboratório’
Matheus é biomédico e há quase 20 anos se dedica a pesquisa com um objetivo: encontrar nas análises uma solução que pudesse ajudar a salvar pessoas.
Ele ainda não sabia que trabalharia com câncer quando começou a pesquisa que deu base à descoberta, há quase dez anos, e diz que a solução que encontrou foi quase um “acidente de laboratório”.

Ele ainda estava no Brasil em uma pesquisa sobre como as células se dividiam. Para poder ver melhor, aplicou uma substância que deveria agir como um estimulante, fazendo com que as células se multiplicassem mais rápido. No entanto, o que ele viu foi completamente o contrário.
A gente não acreditou no que estava vendo, refizemos os testes inúmeras vezes e o resultado era sempre o mesmo. Foi quando percebemos que tínhamos um achado. Quando esse sinal para a célula se multiplicar aumenta, gera um stress tão intenso que ela não consegue mais lidar com isso. Então, ela se divide menos. — Matheus Henrique Dias, pesquisador.
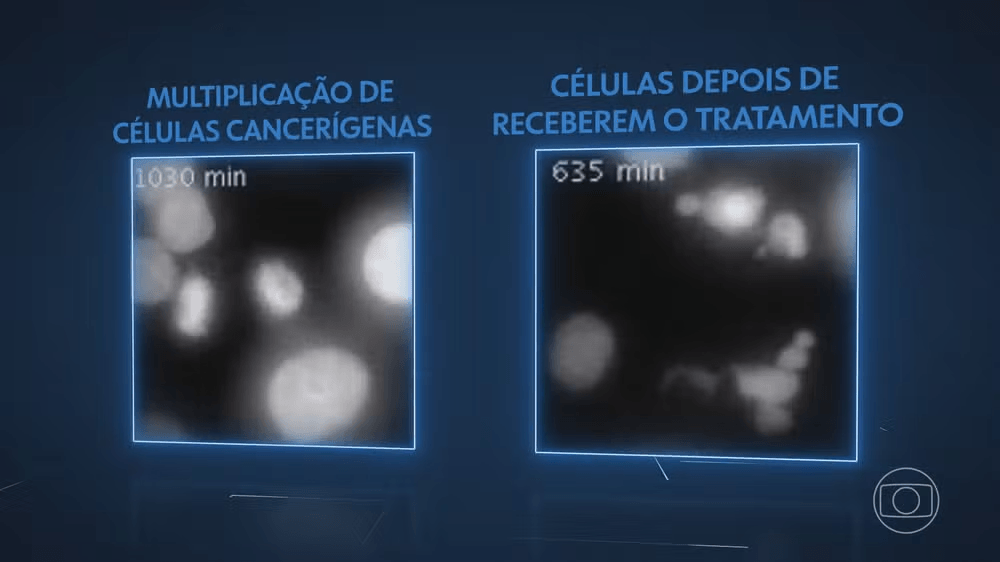
Imagens de microscópio mostram como células de câncer normalmente se multiplicam. Do outro lado, as células que receberam a combinação de medicamentos. Elas até tentam, mas já não conseguem se multiplicar.
Depois dessa etapa, Matheus decidiu aplicar a descoberta em células de câncer e foi chamado para o Netherlands Cancer Institute, na Holanda, onde passou cinco anos até encontrar a resposta para o tratamento.
🔔 Inscreva-se na Nature & Space no YouTube, Explore Nossas Coleções Temáticas!
LEIA MAIS
TESTE REDUZIU IDADE BIOLÓGICA 15 ANOS AO RETIRAR 3 ALIMENTOS
MAGNETISMO TRATA DOENÇAS DEGENERATIVAS E PSIQUIÁTRICAS
Como funciona o tratamento?
O tratamento, publicado na revista científica “Câncer Discovery“, uma das mais renomadas no tema, traz como solução a união de duas medicações que conseguem estressar a célula, depois, impedir que ela tente se corrigir. Com isso, as células cancerígenas morrem.
O primeiro autor é Matheus Henrique Dias, um brasileiro que atualmente é um pesquisador sênior de pós-doutorado no Netherlands Cancer Institute (NKI).
Uma combinação de dois medicamentos foi capaz de suprimir tumores de uma maneira não convencional. Em vez de inibir a divisão de células tumorais, como os medicamentos mais amplamente usados fazem, a estratégia consistiu em hiperativar a sinalização oncogênica por essas células até o ponto em que elas ficaram estressadas.
O outro medicamento então atacou as células estressadas. A abordagem será testada em pacientes com câncer colorretal na Holanda no final de 2024.
A ideia começou a se desenvolver enquanto Dias fazia pesquisa de pós-doutorado no Instituto Butantan, em São Paulo, Brasil, e um estágio na Universidade de Liverpool, no Reino Unido.
O projeto foi conduzido sob a égide do Center for Research on Toxins, Immune Response and Cell Signaling (CeTICS), um Centro de Pesquisa, Inovação e Difusão (CEPID) financiado pela FAPESP.
“Naquela época, descobrimos que um gene conhecido como fator de crescimento de fibroblastos 2 [FGF2] inibia a multiplicação de células tumorais em vez de estimulá-la, como acontecia no caso de células saudáveis. Isso foi uma surpresa, pois era o oposto do que deveria acontecer”, contou Dias.
Na época, um estudo sobre o papel do FGF2 foi publicado na revista Molecular Oncology .
Neste último artigo, os pesquisadores mostram que as células cancerígenas não se multiplicam menos porque são inibidas diretamente por um medicamento, como no caso da quimioterapia convencional.
Pelo contrário, um dos medicamentos usados nessa estratégia desencadeia a hiperativação da sinalização das células tumorais, estressando as células e tornando-as sensíveis a medicamentos específicos para células nesse estado.
“Como uma analogia grosseira, imagine que você está em um carro muito rápido e, em vez de frear para pará-lo, você pisa forte no acelerador até o motor superaquecer. E você desliga o sistema de arrefecimento exatamente quando o motor fica realmente quente”, disse Dias.
LEIA MAIS
CIÊNCIA REVELA RELAÇÃO ENTRE CÉREBRO, INTESTINO E EMOÇÕES
SANEAMENTO E SAÚDE AMBIENTAL: A EVOLUÇÃO DOS BANHEIROS NA HISTÓRIA
Ataque duplo sobre as células será testado em outra área
Outro coautor do estudo, Marcelo Santos da Silva , professor do Instituto de Química da Universidade de São Paulo (IQ-USP) apoiado pela FAPESP, fazia pós-doutorado no Instituto Butantan na mesma época que Dias e desenvolveu um ensaio para quantificar o estresse em células tumorais.
“Quando as células tumorais são hiperativadas, elas replicam o DNA ainda mais rápido do que o normal, mas seu DNA é danificado porque elas não estão equipadas para lidar com uma replicação tão rápida. Isso é conhecido como estresse replicativo”, ele disse.
Observando que a hiperativação do FGF2 estressava as células o suficiente para inibir sua multiplicação, Dias decidiu procurar uma molécula que pudesse induzir esse processo.
O candidato mais promissor era o LB-100, atualmente sendo testado em ensaios clínicos para confirmar que ele torna os tumores de pulmão sensíveis a medicamentos quimioterápicos.
Para atacar as células estressadas pela ação do LB-100, os pesquisadores escolheram inibidores da proteína WEE1, que é responsável justamente por reparar danos no DNA tumoral.
Quando esse mecanismo não está funcionando, as células tumorais se dividem antes de completar a replicação do DNA e morrem como resultado.
“A parte mais interessante é que as células cancerígenas desativam as vias oncogênicas para sobreviver a essa abordagem e então se comportam como células saudáveis”, disse Dias.
Os testes envolveram células tumorais colorretais retiradas de biópsias humanas e implantadas em camundongos. O tratamento com os dois medicamentos inibiu o crescimento do tumor nos animais.
À luz do sucesso em modelos de câncer colorretal, os pesquisadores passaram a testar a combinação em linhagens de células de adenocarcinoma pancreático e colangiocarcinoma (ducto biliar).
Esses são tipos de câncer mais raros e agressivos, com poucas opções de tratamento. Os resultados foram igualmente promissores.
“Este é um campo de pesquisa crescente, com grandes corporações investindo em ativadores de sinalização e startups sendo fundadas para desenvolver esse tipo de medicamento. Nos próximos anos, alguns estarão no mercado como opções para tratamento de câncer. Esperamos que um deles seja o nosso”, disse Dias.
Na USP, Silva planeja aplicar o princípio usado no potencial tratamento do câncer para eliminar parasitas causadores de doenças tropicais negligenciadas.
Os protozoários causadores da doença de Chagas e outros causadores da leishmaniose se comportam de forma semelhante às células cancerígenas, pois se replicam muito rapidamente dentro das células hospedeiras.
“Proponho usar um medicamento que estimule a via de sinalização de proliferação em parasitas o suficiente para causar o mesmo tipo de dano ao DNA, e então administrar outro medicamento para reparar o DNA. Isso deve eliminar o parasita sem danificar as células hospedeiras”, disse Silva.
🔔 Inscreva-se na Nature & Space no YouTube, Explore Nossas Coleções Temáticas!
Política de Uso
A reprodução de matérias é livre mediante a citação do título do texto com link apontando para este texto. Crédito do site Nature & Space
NOVA TÉCNICA DESTRÓI CÉLULA CANCERÍGENA COM SOBRECARGA E AUTODESTRUIÇÃO
Fontes
Article Title
Paradoxical Activation of Oncogenic Signaling as a Cancer Treatment Strategy
DOI: 10.1158/2159-8290.CD-23-0216
EurekAlert
Site G1
Brasileiro lidera pesquisa que muda radicalmente a forma de combater as células de câncer